優於單抗ADC?康寧傑瑞、百奧賽圖角逐雙抗ADC賽道
近期,美股上市公司Zymeworks因在研的HER2雙抗ADC新藥ZW49治療實體瘤的I期臨牀數據不達預期,導致股價發生暴跌。
ZW49在臨牀I期階段便遭遇挫折,無疑給其他在研雙抗ADC藥物帶來了壓力。更何況,雙抗ADC爲新興技術,目前尚處於摸索驗證階段,最終能否成藥仍有待驗證。
因此,究竟哪款在研藥物能打破藩籬、成爲全球首款獲批上市的雙抗ADC產品,一直是市場關注的焦點。
一、優於單抗ADC?雙抗ADC緣何成新興前沿技術?
正如達爾文在《進化論》中所言:“物競天擇,適者生存。”雙抗ADC的出現,恰巧說明了腫瘤治療的方法一直在不斷演變。
從小分子靶向藥到單抗,再到藥物效果“1+1>2”的雙抗,乃至被奉爲前沿技術的組合藥物ADC,不僅詮釋了腫瘤治療的演變,而且趨向於不同治療方法之間的聯合應用。
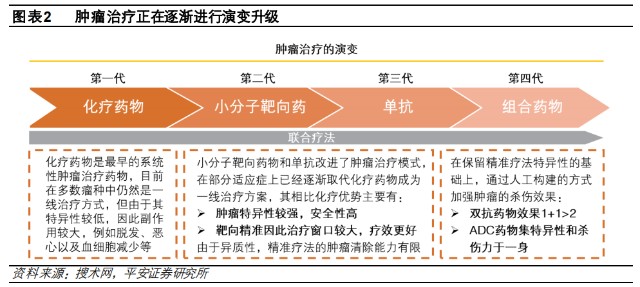
腫瘤治療藥物之所以不斷演變,就在於藥物的局限性。
由於化療藥物的副作用較大,誕生了安全性高、療效更好的小分子靶向藥、單抗藥物;由於單抗受限於腫瘤的異質性,對腫瘤清除能力有限、靶向性較差且存在復發或耐藥的缺陷,促使雙抗藥物誕生。
另外,在聯合治療的理念下,ADC(一種將小分子細胞毒素藥物通過連接子與單克隆抗體偶聯形成的藥物)也由此誕生。
與腫瘤治療方法不斷演變一樣,ADC藥物經歷了三代技術的更迭,包括抗體、連接子、細胞毒性載荷等構成要素以及DAR、偶聯方式等都發生了改變,同時治療效果也在不斷提高。
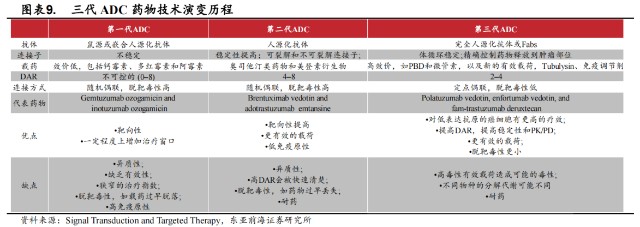
但即便是第三代ADC藥物,仍舊存在缺點。例如,高毒性有效載荷造成可能的毒性;不同物種的分解代謝可能不同;產生耐藥問題等。
即便是如日中天、引領ADC賽道的DS-8201,也因爲有幾率發生間質性肺炎而被FDA添加黑框標籤警告。爲此,科學家們正努力尋找下一代創新ADC藥物技術。
由於ADC主要包含抗體、連接子、細胞毒素三個構成要素,而不同的構成要素,不同的設計組合,都會影響到ADC最終成藥的質量。因此,ADC研發的核心,就在於三個構成要素的結構設計。
基於此,雙抗ADC藥物橫空出世。
此前,爲了實現腫瘤的精準靶向,ADC的抗體部分使用的是高度靶向特異性強的單抗,特別是以靶向HER2的單抗居多。
例如,基因泰克(Genentech,後被羅氏收購)的T-DM1(赫賽萊、Kadcyla、恩美曲妥珠單抗)、第一三共/阿斯利康的DS-8201(T-DXd,Enhertu,德喜曲妥珠單抗)、Ambrx/浙江醫藥的ARX788、Synthon的SYD985,這四款HER2 ADC在抗體部分使用的都是靶向HER2的單抗——曲妥珠單抗(赫賽汀),包括榮昌生物的HER2 ADC藥物維迪西妥單抗(RC48),在抗體部分選用的迪西妥單抗也是針對HER2靶點。
但是,相較於單抗,由於雙抗是將兩個靶點識別區域結合在一個抗體上,能產生單抗或聯用所不具備的新的藥物機制,靶點間的協同效應更強,既提升了藥物的靶向特異性以及腫瘤殺傷作用,也減少了毒副作用並解決耐藥性的問題。
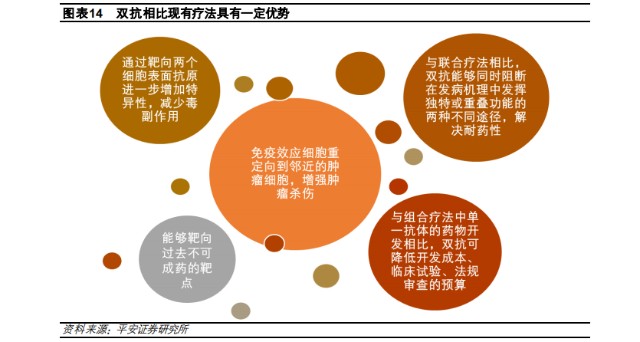
因此作用在ADC藥物上,雙抗不僅能達到比單抗更好的細胞內吞,能降低因爲未被內吞而可能導致脫靶毒性,而且雙抗ADC相比單抗ADC的毒素積累量更高,細胞毒性更強,能夠更有效的殺傷腫瘤細胞。
所以,理論上療效更顯著且能規避同質化的雙抗ADC,便成爲了藥企們爭相湧入的賽道。
二、雙抗ADC尚處早期探索階段,HER2雙抗ADC佔主導
由於雙抗ADC領域尚處於早期探索階段,目前在研產品較少,而且大多數處於臨牀前期階段。
從在研情況看,或許是基於成熟靶點HER2已經在各種療法中得到充分驗證,以及出於研發風險低、成功率高的考量,目前雙抗ADC在研藥物主要以HER2雙抗ADC爲主。
根據西南證券研報顯示,全球處於臨牀階段的HER2雙抗ADC的藥物一共有5個,分別是AstraZeneca的MEDI4276、康寧傑瑞的JSKN003、Zymew orks/百濟神州的ZW49、康明百奧的KM501、百奧賽圖的YH012。其中I期及I/II期臨牀3個,臨牀前2個。國內在研3個,其中申報臨牀1個,臨牀前2個。
具體來看,Zymeworks研發的ZW49屬於HER2雙表位雙抗ADC新藥。2018年11月,百濟神州向Zymeworks引進了ZW25以及ZW49於亞洲(日本除外)、澳洲以及新西蘭的开發及商業化權利。
所謂同抗原雙表位類雙抗,屬於雙抗七種作用機制的其中之一,是通過同時結合腫瘤細胞某一信號通路中相同抗原的兩個非重疊表位,以增強抗體-抗原相互作用。例如,康寧傑瑞的KN026、Zymeworks/百濟神州的ZW-25,都是屬於同時結合HER2的兩個非重疊表位的同抗原雙表位類雙抗。
這種聯合治療的方式在治療效果上優於單藥治療,並且在此基礎上开發的HER2雙抗ADC,有望對曲妥珠單抗、帕妥珠單抗甚至TDM-1等ADC藥物耐藥的患者,起到良好治療效果。
基於此,Zymeworks在ZW25的基礎上進一步开發了ZW49,康寧傑瑞也在雙抗藥物KN026(HER2HER2)的基礎上設計和改造出了HER2雙表位雙抗ADC新藥——JSKN003。
以ZW49爲例,抗體部分採用了與ZW25(同時特異性結合HER2受體的兩個非重疊表位,即帕妥珠單抗結合位點和曲妥珠單抗結合位點)類似的抗體結構,連接的細胞毒素是化療藥物auristatin衍生的微管抑制劑,並通過公司專有的Azymetric™ Bispecifics和ZymeLink™ ADCs平臺共同开發得到。
不過,遺憾的是,近期Zymeworks發布了ZW49治療實體瘤的I期臨牀數據不達預期的消息。
根據Zymeworks在ESMO(歐洲腫瘤內科學會)上公布的摘要信息信息,截至2022年3月10日,76名患者接受了ZW49治療。其中28%爲胃癌患者,22%爲乳腺癌患者;70%之前接受過HER2靶向治療;先前轉移治療的中位數爲3(範圍:1-16)。68(89%)名患者出現與治療相關的不良事件;大多數嚴重程度爲1或2級。最常見的TRAE包括角膜炎(42%)、脫發(25%)和腹瀉 (21%)。7(9%)名患者出現≥3級TRAE,包括2例4級(輸液相關反應 [n=1] 和中性粒細胞計數減少[n=1])。3例報告了嚴重的TRAE,導致1例停藥;其他2名患者因TRAE而出現停藥。沒有發現間質性肺病和治療相關的死亡。在使用2.5mg/kg Q3W的ZW49治療的29名可評估療效的患者中,ORR爲28%,DCR爲72%。ZW49的DAR值爲2。

ZW49的I期研究的初步結果 來源:ESMO 2022摘要書
另外,阿斯利康研發的雙表位四價HER2 ADC藥物MEDI4276,雖然對於曲妥珠單抗、帕妥珠單抗和T-DM1耐藥模型都展現出了良好的療效,但是由於出現導致停止治療的不良事件以及劑量限制性毒性的問題,MEDI4276被終止开發。
整體而言,靶向同一抗原的2個不同結合表位這一路徑的雙抗ADC藥物,除了HER2 雙抗ADC以外,還有再生元的cMet/cMet雙抗ADC(REGN5093-M114),目前已處於I/II期臨牀試驗。
除此以外,還有靶向同一癌細胞上的2個不同抗原的研發路徑。例如,由Sutro和默克(EMD Serono)共同研發的M1231,就是同時靶向MUC1和EGFR的雙抗ADC在研藥物。
三、康寧傑瑞、百奧賽圖角逐雙抗ADC賽道
從前文所述可以看到,無論是前三代ADC藥的研發,還是新一代的雙抗ADC藥物,一直都離不开解決毒性、安全性的問題。
其實,本質上就是解決ADC結構設計的問題,也就是該如何找到抗體、細胞毒素和連接子這三個構成要素之間的平衡點。
畢竟,抗體、連接子、小分子細胞毒素的不同選擇,決定了ADC最終成藥的質量。例如,抗體是否具備高特異性、內吞作用決定了臨牀療效;細胞毒素的高低決定了殺傷力;連接子是否切割,均一性高低、偶聯方式的選擇等決定了安全性。
可見,無論是Zymeworks的ZW49,還是阿斯利康的MEDI4276,臨牀數據不佳的原因就在於,沒能解決好連接子、細胞毒素帶來的毒性問題。
另外,由於ADC的三個構成要素均可以替換、組合設計,使得很多藥企爭相入局ADC賽道,以求摸着石頭過河、實現彎道超車。
不過,雖然賽道入局者衆、靶點也呈現同質化,看起來很“內卷”,但由於ADC作用機制的特殊性,即便是同靶點也能做出適應症差異化。畢竟,解決這一問題的關鍵,還是在於藥企的技術平臺、綜合研發實力。
值得一提的是,目前國內藥企研發ADC藥物主要有兩種常見的模式:要么是將擅長的快速跟隨模式(Fast Follow)的模仿性創新優勢復制到ADC上,通過對新藥進行分子結構改造或修飾,研發出Me too、Me-better或Me-worse產品,要么是與同一家或少數幾家擁有ADC技術平臺的企業達成合作。
這兩種常見的研發模式,第一種帶來的結果往往是沒能成功“抄作業”,甚至連Me too產品都造不出,即便能通過“抄作業”研發出產品,但臨牀數據也往往不達預期,導致藥企忍痛止損。
第二種模式,則會導致缺乏自主創新,技術含金量較低。例如,國內很多藥企都從Synaffix購买糖基偶連技術,但糖基偶連只是五種定點偶聯技術的其中之一。更何況,即使是第三代ADC藥物採用的定點偶聯技術,也不能研發出沒有任何安全性問題的產品。
可見,對於更加考驗技術平臺、綜合研發實力的ADC藥物而言,擁有自主研發技術平臺的藥企,成功概率或許更大,當然試錯的成本也會更低。
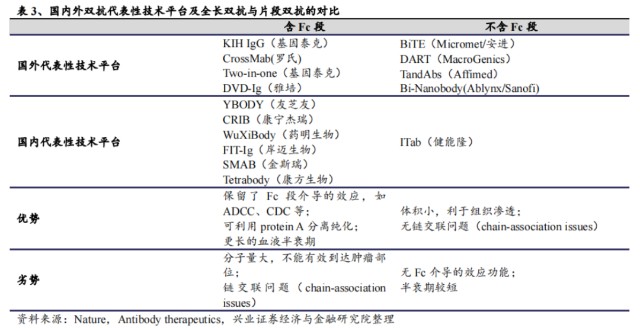
目前,國內具有代表性技術平臺,包括康寧傑瑞的CRIB、岸邁生物的FIT-Ig、康方生物的Tetrabody等,共同點都是含Fc段的雙抗(全長雙抗),優勢在於保留了Fc段介導的效應,如ADCC、CDC等;可利用protein A分離純化;更長的血液半衰期。
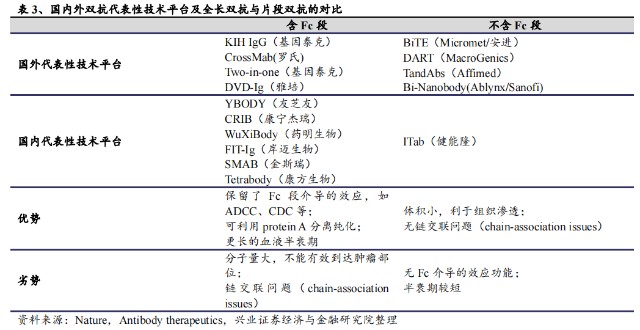
例如,康寧傑瑞的雙抗ADC藥物JSKN003,就是在其基於Fc的異二聚體雙特異性抗體研發平臺,即電荷排斥誘導雙特異性(CRIB)平臺以及多功能免疫調節抗體技術(包括BADC等)的基礎上進行开發。
雖然康寧傑瑞做的是成熟靶點HER2,不像其他藥企都在做新靶點,但公司利用前沿技術整合並搭建的定點偶聯平臺,依托的是自主开發的抗體偶聯技術,並憑借獨有的糖基化定點偶聯方式對標DS-8201。
根據臨牀前研究顯示,JSKN003具有更好的穩定性和可比的腫瘤抑制活性。2022年8月,JSKN003的IND申請已提交國家藥監局並獲受理用於治療實體瘤,這也是國內首個申請臨牀試驗的雙抗ADC藥物。
另外,百奧賽圖也基於公司的RenLite全人抗體小鼠平臺开發了兩款雙抗ADC藥物,分別是TROP2/HER2雙抗ADC藥物YH012、MET/EGFR雙抗ADC藥物YH013,計劃用於治療實體瘤,目前均處於开發階段。
而且,百奧賽圖利用該雙抗ADC研發平臺,還可實現高通量篩選和开發雙抗ADC組合,源源不斷產生具備高度差異化和創新性的雙抗ADC分子。
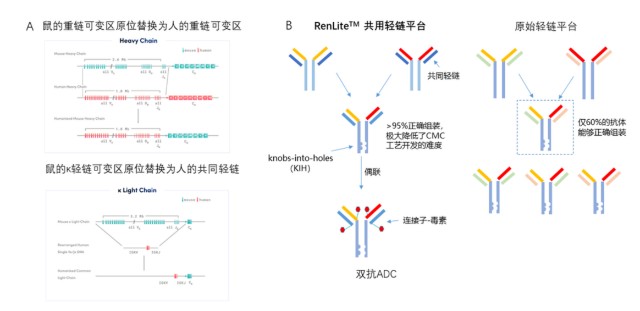
基於RenLite平臺高通量地產出雙抗ADC 來源:百奧賽圖官網
結語:綜合來看,是否擁有自主研發平臺,對於考驗綜合研發實力、結構設計的雙抗ADC藥物的研發而言,無疑至關重要。
畢竟,能在早期探索階段便爭取最低成本的試錯、提高研發的成功率。就看康寧傑瑞、百奧賽圖等國內藥企能否順利告捷了。
- 康寧傑瑞制藥-B(09966)
- 康方生物-B(09926)
- 百奧賽圖-B(02315)
- 榮昌生物(688331)
- 百濟神州-U(688235)
本文作者可以追加內容哦 !
